 |
| Boyle, Charles y Gay Lussac |
Los gases son elementos de la materia con características muy especiales. Algunos gases son el oxígeno, el helio, el neón, entre otros.
Los átomos de casi todos los gases ya tienen sus 8 electrones en la última capa de sus niveles de energía, por tanto, según la ley del octeto, estos no reaccionan con otros elementos ni consigo mismos porque ya están completos, no les faltan ni les sobran electrones.
Como casi todos los gases no necesitan dar ni recibir electrones, estos no reaccionan con otros átomos. Esto provoca que los átomos de gas se alejen unos de otros ya que no hay fuerza de atracción entre ellos.
Los científicos Boyle, Charles y Gay-Lussac descubrieron de manera independiente las leyes que describen el comportamiento de los gases y determinaron unas fórmulas muy simples, pero efectivas, para entender cómo influyen los factores que inciden en los gases.
Los tres factores importantes a tomar en cuenta son la presión, el volumen y la temperatura. La presión es la fuerza aplicada sobre un área determinada y su unidad de medida es el Pascal (P). El volumen es el espacio que ocupa un objeto y su unidad de medida es el metro cúbico (m³). La temperatura es una medida de la energía cinética relacionada con los átomos y su unidad de medida para trabajar con los gases es el Kelvin (°K).
Ya sabiendo los factores que influyen en el comportamiento de los gases, vamos a ver las leyes de los gases y algunos ejemplos.
LEY DE BOYLE
Boyle estudió cómo se comportan los gases cuando la temperatura se mantiene igual. Su ley postula que cuando la temperatura es constante (es decir, cuando permanece igual), el volumen del gas es inversamente proporcional a la presión.
En otras palabras, mientras mayor presión se ejerza a un gas, menor será el volumen o el espacio ocupado por el gas; y mientras menor sea la presión ejercida, mayor será el volumen del gas. Esto se debe a que los átomos de los gases se alejan unos de otros, pero si ejercemos presión, los átomos se acercarán más y ocuparán menos espacio.
La fórmula que describe este comportamiento es P1V1=P2V2. Significa que la presión #1 o inicial multiplicada por el volumen #1 o inicial es igual a la presión #2 o final multiplicada por el volumen #2 o final. Para buscar las variables en algún ejercicio sobre gases, solo debes despejar la variable que necesitas.
 |
| El gas del frasco de la derecha ocupa menos espacio porque la placa ha sido empujaba con mayor presión hacia abajo. |
LEY DE CHARLES
Charles estudió cómo se comportan los gases cuando la presión es constante. La ley de Charles expresa que cuando la presión se mantiene igual, el volumen y la temperatura son directamente proporcionales. Es decir, si la temperatura aumenta, el volumen del gas también aumenta, y si la temperatura baja, el volumen del gas también disminuirá.
La fórmula que describe esa proporcionalidad es: V1/T1=V2/T2. El valor del volumen #1 dividido entre la temperatura #1 es igual al valor del volumen #2 entre el valor de la temperatura #2.
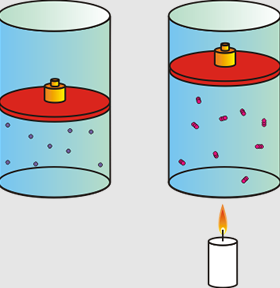 |
| El gas de la derecha aumentó su volumen debido al aumento de la temperatura provocado por el calor de la llama de la vela. |
 |
| En un recipiente que no cambia su volumen, los gases sometidos a un aumento de temperatura aumentan la presión hacia el recipiente, como se muestra en la imagen de la derecha. |
Es muy importante conocer el comportamiento de los gases ya que forman parte de nuestra vida, desde componer el aire que respiramos, hasta sus usos en los combustibles gaseosos.